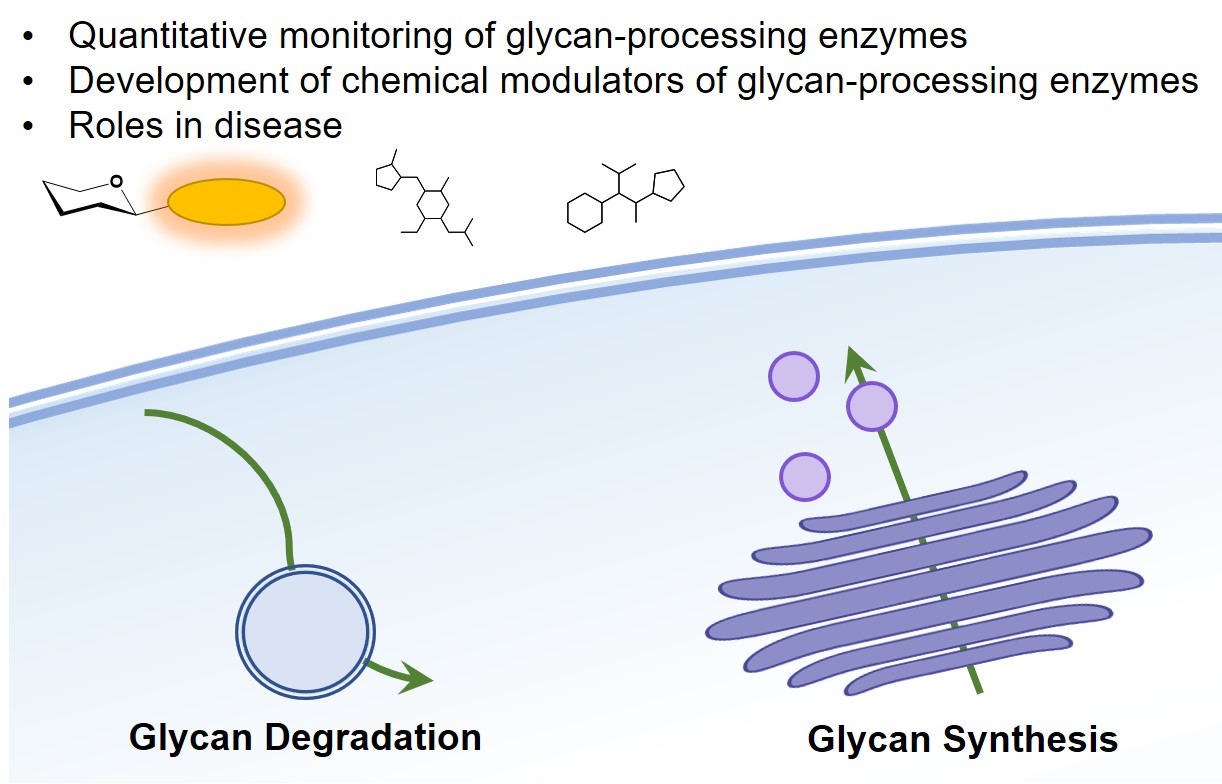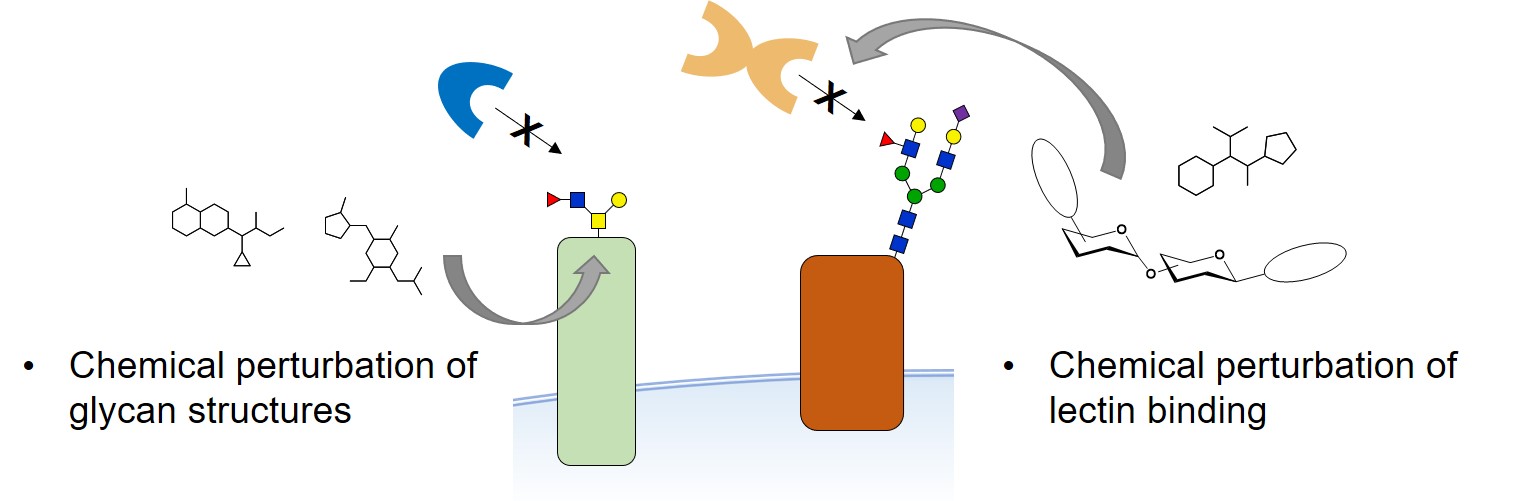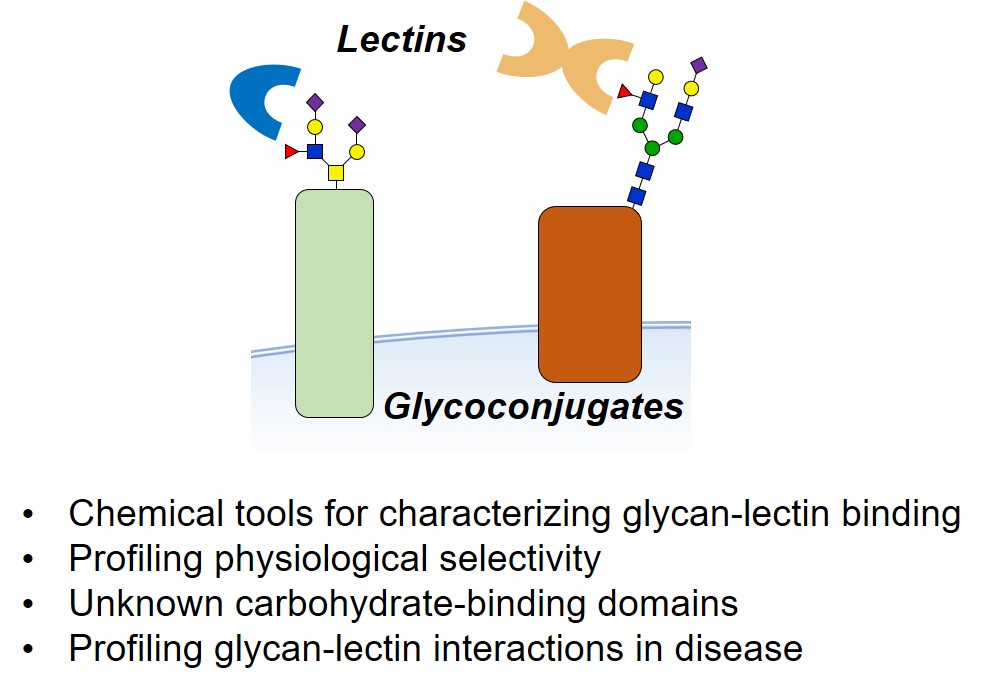
Analyser et comprendre les interactions glycanes-protéines dans leur environnement physiologique demeure particulièrement difficile. Pour de nombreuses protéines reconnaissant les glycanes (lectines), les ligands glycoconjugués endogènes sont inconnus. En outre, l’existence de domaines, ou de lectines, encore non-identifiés reste une question de première importance.
Les approches biochimiques classiques ne permettent pas de capturer et de caractériser les interactions glycanes-protéines à la surface des cellules. Notre groupe travaille sur des sondes chimiques et des stratégies de chimie biologique qui pourraient apporter des solutions aux limites des technologies actuelles.